AMIOTROFIA ESPINHAL - A.M.E
10 agosto, 2022
AMIOTROFIA ESPINHAL AME
" quem tem AME tem pressa" essa frase é devido ao fato que o quanto antes iniciar a terapia medicamentosa melhor será para o paciente.
A atrofia muscular espinhal consiste em um grupo de doenças neuromusculares autossômicas recessivas monogênicas caracterizadas pela degeneração dos neurônios motores alfa na medula espinhal, resultando em atrofia muscular proximal progressiva, fraqueza e paralisia .
A atrofia muscular espinhal é o segundo transtorno autossômico recessivo fatal mais comum após a fibrose cística, com uma incidência estimada de 1 / 6.000 a 1 /10.000 nascidos vivos e tem uma frequência de portadora de 1 em 54 pessoas.
Com base na idade de início, máxima do motor função alcançado e prognóstico, SMA é clinicamente classificados em cinco fenótipos (SMA tipos 0-4)
A atrofia muscular espinhal tipo 1 (também chamada de doença de Werdnig- Hoffmann ) é o tipo mais grave e comum e é responsável por aproximadamente 50% de todos os casos de AME
Bebês com SMA tipo 1 geralmente apresentam sinais clínicos durante os primeiros meses (geralmente em 4 a 5 meses) de vida e não atingem marcos motores básicos de desenvolvimento, como a capacidade de sentar-se sem assistência. Na ausência de uma intervenção externa, os pacientes com SMA tipo 1 geralmente não sobrevivem além dos primeiros 2 anos .
Aparecimento de fraqueza na SMA tipo 2 (doença Dubowitz) é geralmente visto entre 6 a 18 meses de idade permitindo que os pacientes a desenvolver a capacidade de se sentar, mas nunca de andar sem ajuda, resultando em uma maioria de sobreviver na idade adulta.
A atrofia muscular espinhal tipo 3 (doença de Kugelberg-Welander) é caracterizada por uma idade de início entre 18 meses e 18 anos, em que as crianças aprendem a andar sem ajuda, mas perdem essa capacidade de andar na infância ou no início da idade adulta.
Outras variantes raras incluem SMA tipo 4, onde o início é na idade adulta e
SMA tipo 0, onde o início é no útero e a criança tem pouca movimentação e muitas vezes com mal formação cerebral
O padrão de herança genética da AME é autossômico recessivo, sendo dois genes associados à doença, o SMN1 e o SMN2.
Estudos genéticos revelam que a AME é causada por uma deleção ou mutação homozigótica do gene 1 de sobrevivência do motoneurônio (SMN1), localizado na região telomérica do cromossomo 5q13, sendo que o número de cópias de um gene semelhante a ele (SMN2), localizado na região centromérica, é o principal (mas não o único) determinante da gravidade da doença.
Mais de 95% dos pacientes apresentam mutação em homozigose no gene SMN1, entretanto, todos retêm pelo menos uma cópia do gene SMN2, homóloga ao gene SMN1, com capacidade de produzir pelo menos 10% da proteína funcional
A ausência de SMN2 não tem consequências clínicas, sendo encontrada em aproximadamente 5% dos indivíduos normais.
A alteração genética no gene SMN1 é responsável pela redução dos níveis da proteína de sobrevivência do motoneurônio (SMN), determinando, por conseguinte, degeneração de motoneurônios alfa, localizados no corno anterior da medula espinhal, resultando em fraqueza e paralisia muscular proximal progressiva e simétrica.
Os estudos de genética molecular são definitivos para o diagnóstico da amiotrofia espinhal. Aproximadamente 95-98% dos pacientes apresentam deleção dos éxons 7 e 8 do gene SMN1, enquanto que 2-5% apresentam deleção em um alelo e mutação de ponto no outro alelo. Devido a esse espectro uniforme de mutação, a análise molecular realizada mais frequentemente é a detecção de deleções e conversões dos éxons 7 e/ou 8 dos genes SMN1 e SMN2 nos pacientes com suspeita clínica, por meio da pesquisa de deleção do gene SMN1.
Se o paciente com suspeita de ter AME possuir uma cópia do gene SMN1, deve-se investigar se essa cópia remanescente contém mutações brandas, como mutações pontuais, inserções e deleções, por meio de sequenciamento.
A gravidade é também dependente na o número de cópias do SMN2 gene, que é parálogos para o humano SMN gene e também localizado no cromossoma 5q. Diferindo por um único nucleotídeo, SMN2 pode codificar uma proteína instável truncada semelhante à proteína SMN que é funcional em cerca de 10% dos casos. Foi assim estabelecido que o número de cópias do SMN2 gene pode resultar em um favorável prognóstico em SMA .
Além isso, adequadas modificações nos nucleótidos pode ainda melhorar a produção da funcional SMN proteína.
Até recentemente, a base do tratamento para pacientes com SMA era a assistência médica de suporte, incluindo reabilitação, tratamento ortopédico , nutrição, saúde gastrointestinal e óssea .
Atualmente, não são três modificadores da doença, tratamentos para o
tratamento de SMA: nusinersen, onasemnogene abeparvovec-xioi, e, mais
recentemente, risdiplam.
A forma mais comum de SMA é causada por uma perda ou mutação no gene do neurônio motor de sobrevivência humana ( SMN ) no cromossomo 5q11.2-q13.3, que leva a concentrações reduzidas de proteína SMN e disfunção seletiva dos neurônios motores .
Um dos novos , o ZOLGENSMA (onasemnogene abeparvovec-xioi,) é uma terapia gênica baseada em vetor de vírus adeno-associado que pode transduzir uma cópia do gene SMN humano em células que podem expressar a proteína SMN funcional .
.
O outro dois novos medicamentos- nusinersen e risdiplam, atuam modificando o SMN2 mecanismo de uni para
aumentar a concentração de funcional proteína criada pelo gene. Ao contrário do onasemnogene abeparvovec-xioi, que é uma terapia genética única, o nusinersen e o risdiplam requerem tratamento repetido .
Onasemnogene abeparvovec é um sorotipo 9 de vírus adeno-associado recombinante não replicante (AAV9) contendo o gene SMN humano sob o controle do intensificador de citomegalovírus (CMV) / promotor híbrido de β-actina de galinha (CB). Como mencionado anteriormente, a droga atua por entrega de uma cópia do SMN gene usando uma viral vetor, oque resulta em aumento da SMN proteína expressão em neurónios motores, impedindo assim a morte celular, melhorando neuronal e muscular função, e aumentar a sobrevivência global paciente . Ele é transmitido como o de uma só vez de uma dose única intravenosa (IV) de infusão.
Nusinersen é um oligonucleotídeo antisense (ASO) cuja abordagem terapêutica para tratar SMA é baseada no aumento da quantidade de proteína de comprimento total produzida a partir do gene SMN2 modulando seu padrão de splicing de ácido ribonucleico mensageiro (mRNA) . Ele é concebido para intratecal (IT) de administração para o cefalorraquidiano fluido para facilitar a distribuição para o centro nervoso sistema (SNC). Após quatro doses de carga , o nusinersen requer doses de manutenção uma vez a cada 4 meses.
Risdiplam é uma pequena molécula administrada por via oral e um modificador de splicing direto SMN2 de RNA projetado para aumentar a inclusão do exon 7 no mRNA de SMN2 em pacientes com SMA causada por mutações no cromossomo 5q . A vantagem essencial de risdiplam é a capacidade de atravessar facilmente a barreira sangue-cérebro, mesmo após a administração oral permitindo restauração de SMN expressão no SNC e na periferia
Baranello, G. , et al. (2021) "Risdiplam in Type 1 Spinal Muscular
Atrophy", New England Journal of Medicine , 384 (10), pp. 915-923 doi:
10.1056 / NEJMoa2009965.
Ben-Shachar, S. , et al. (2011) " Triagem de população em grande
escala para atrofia muscular espinhal: implicações clínicas ", Genet Med , 13
(2), pp. 110-4 doi: 10.1097 / GIM.0b013e3182017c05.
D'amico, A. , et al. (2011) "Spinal muscular atrophy", Orphanet J Rare
Dis , 6, p. 71 doi: 10.1186 / 1750-1172-6-71.
Faravelli, I. , et al. (2015) "Atrofia muscular espinhal -
avanços terapêuticos recentes para um velho desafio", Nat Rev Neurol , 11
(6), pp. 351-9 doi: 10.1038 / nrneurol.2015.77.
Finkel, RS , et al. (2017) "Nusinersen versus Sham Control in Infantile-
Onset Spinal Muscular Atrophy", New England Journal of Medicine , 377
(18), pp. 1723-1732 doi: 10.1056 / NEJMoa1702752.
Gow, J. , et al. (2020) "A participação em fóruns de apoio ao paciente pode
colocar os dados de pacientes com doenças raras em risco de
reidentificação", jornal Orphanet de doenças raras , 15 (1), pp. 226-226 doi:
10.1186 / s13023-020-01497-3 .
Iannaccone, S. T. , et al. (2004) "Spinal muscular atrophy", Curr Neurol Neurosci Rep ,
4 (1), pp. 74-80 doi: 10.1007 / s11910-004-0016-6.
International Society of Pharmacoepidemiology (2016) "Guidelines for
good farmacoepidemiology practice (GPP)", Pharmacoepidemiol Drug
Saf , 25 (1), pp. 2-10 doi: 10.1002 / pds.3891.
Mendell, JR , et al. (2017) "Single-Dose Gene-Replacement Therapy for
Spinal Muscular Atrophy", New England Journal of Medicine , 377 (18), pp.
1713-1722 doi: 10.1056 / NEJMoa1706198.
Mercuri, E. , et al. (2012) "Atrofia muscular espinhal na infância: controvérsias e
desafios", The Lancet Neurology , 11 (5), pp. 443-452 doi: https:
//doi.org/10.1016/S1474-4422 (12) 70061-3 .
Sugarman, E. A. , et al. (2012) " Triagem de portadores pan-
étnicos e diagnóstico pré - natal para atrofia muscular espinhal: análise clínica de
laboratório de> 72.400 espécimes", Eur J Hum Genet , 20 (1), pp. 27-32 doi:
10.1038 / ejhg.2011.134.
Vandenbroucke, J. P. , et al. (2007) "Fortalecimento do Relatório de Estudos Observaci
onais em Epidemiologia (STROBE): explicação e elaboração", Epidemiologia ,
18 (6), pp. 805-35 doi: 10.1097 / EDE.0b013e3181577511.

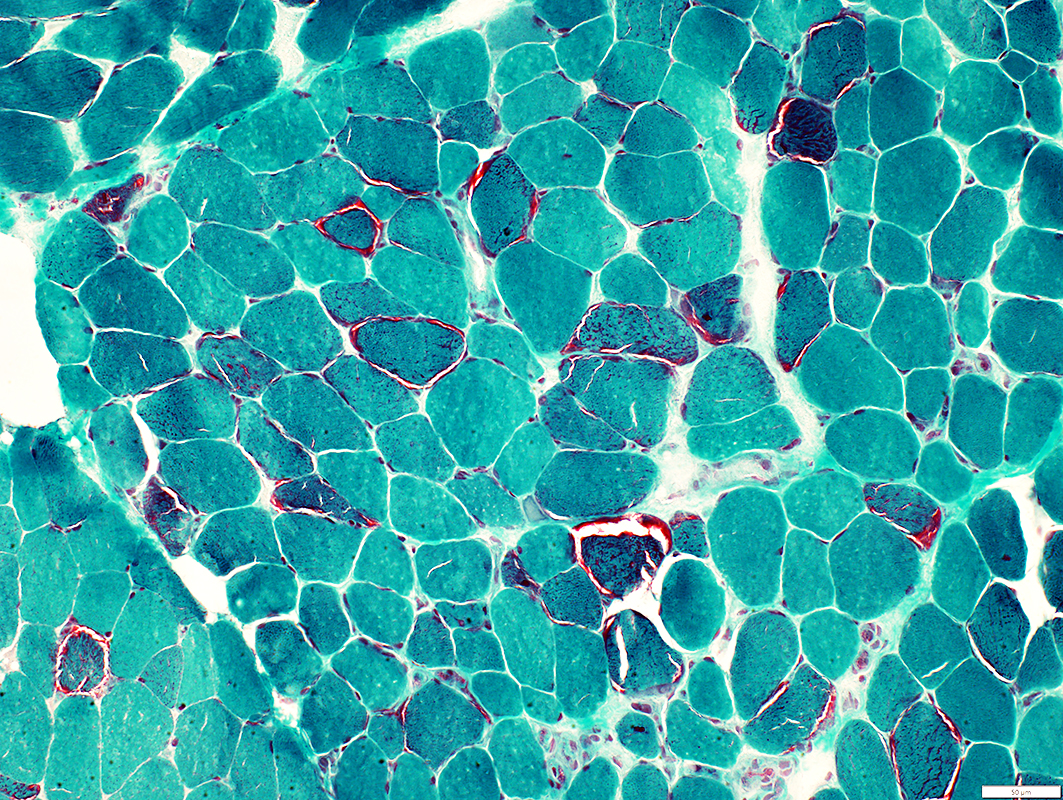 figura 2 : fibras vermelhas rasgadas (red ragged fiber) caracterista da biopsia muscular nas mitocondriopatias
figura 2 : fibras vermelhas rasgadas (red ragged fiber) caracterista da biopsia muscular nas mitocondriopatias